文章由港大醫學院微生物學系名譽助理教授龍振邦、趙晞揚,港大醫學院微生物學系臨牀助理教授薛達,港大醫學院微生物學系講座教授袁國勇撰寫,在12月25日於明報發表。
新型冠狀病毒疫情持續了差不多一年,經過全球各地科研人員的努力,今年冬季終於可以開始接種疫苗。而本港亦準備開展大型接種計劃,期望於未來數月,廣泛接種高效疫苗(註1)。透過增加港人之群體免疫力,預計能阻新冠病毒進一步蔓延,藉此減少感染及死亡個案,並紓緩公營醫療系統及隔離檢疫措施的壓力,減輕政府財政負擔。疫癘威脅漸解,屆時能逐步放寬社交距離措施,重新開放關口,讓市民恢復對外商旅活動,重振經濟,回復正常。
群體免疫 最後一環
清零或持續清零的關鍵在於邊境防控及社區堵截,惟邊境控制難以滴水不漏,因為有約2.5%至5%個案的潛伏期逾14天。另外,社區內的防控堵截亦有困難,因無症狀感染者能於社區播毒,即使有病徵的求診者願意做檢測,也可以因採樣欠佳或測試本身的限制而出現假陰性。而社交距離及高危控制點防控措施未能完全嚴格落實執行,故開展全民疫苗接種計劃刻不容緩。接種計劃必須以迅速、廣泛、公開、自由選擇為目標。所有資訊均須透明公開,以獲取公眾信心。同時應尊重市民意願,予以自由選擇的機會。如此接種計劃才能成功,使防疫更持久、更有效阻截病毒擴散,盡早結束大流行。
承認局限 面對未知
雖然全球皆為疫苗到臨而感到非常鼓舞,惟大眾須知新型冠狀病毒疫苗從未於非實驗環境大規模接種。本港預先採購的3款疫苗中,有兩款所應用的科技平台乃新技術,從未在大型疫苗接種計劃使用。故批准緊急使用,必須以同行評審(peer reviewed)國際醫學期刊刊登的數據作為基礎,獲得藥監管當局緊急使用許可,並遵從國際標準及持續監察疫苗安全、效力及品質。
前期動物實驗顯示3隻疫苗均能誘發適量中和抗體(neutralizing antibody),防止接種者出現有病徵感染或嚴重併發症;但未必能阻止無症狀感染,減滅上呼吸道釋放病毒(viral shedding),因而仍然可能感染其他人。疫苗保護時限、加強劑的數量及相隔時間,尚待考證。
疫苗含微量殘餘化學物或穩定劑,有可能引起過敏反應。淨化過程已將剩餘物減至最少,但注射前必須問清楚接種者的過敏史,所有疫苗接種中心必須有急救設備和訓練有素的人員。可能尚有其他較罕見及嚴重的不良反應,未必於注射1萬人次的實驗研究階段出現;但在大型社區接種計劃,上百萬人次接種後才有機會出現。其他嚴重的副作用,一般指自身免疫炎症反應,如橫貫性脊髓炎(transverse myelitis)、吉巴氏綜合症(Guillain-Barré Syndrome)等,通常於接種後6星期內出現,但屬極罕及無法預計。
天然感染後,黏膜層會出現抗體,形成黏膜免疫力(mucosal immunity)。疫苗注射的黏膜免疫力較弱,而再感染後會否出現疫苗無效的變種病毒(vaccine resistant mutant)屬未知之數。
預購疫苗 數據分析
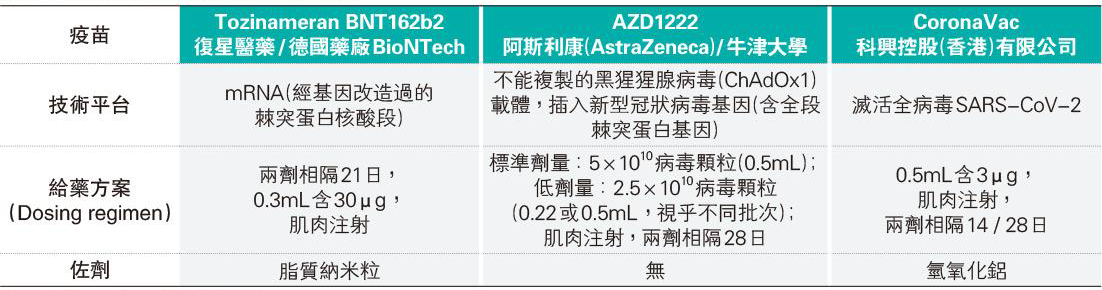
到達第三期臨牀研究階段的新冠疫苗現時約有18隻,大部分疫苗試驗品於動物測試,第一、二期測試均能誘發免疫反應。數據經衛生防護中心科學委員會審視,政府聽取意見後預先採購比本港人口數量多兩倍之疫苗。包括:
- CoronaVac(科興控股(香港)有限公司研發之滅活疫苗);
- AZD1222(阿斯利康(AstraZeneca)/牛津大學所研發之病毒載體疫苗);
- Tozinameran BNT162b2(復星醫藥/德國藥廠BioNTech (mRNA核酸疫苗))。
(註2、3、4、5)

CoronaVac內含滅活全病毒,包括抗原及病毒其他部分,如棘突蛋白(S-蛋白)、封套蛋白、膜蛋白、核殼蛋白(N-蛋白)、病毒RNA以及氫氧化鋁(aluminium hydroxide)等佐劑(註2)。其詳細成分尚未公布,但一般滅活疫苗內多數含微量細胞培養原材料(如細胞殘餘)、用來滅活的化學物(如beta-propiolactone)及穩定劑。注射滅活全病毒疫苗後,體內的樹突細胞及巨噬細胞會將病毒抗原帶到淋巴細胞,通過刺激Th2免疫反應,製造大量針對棘突蛋白的中和抗體,及針對病毒其他蛋白的非中和抗體(non-neutralizing antibody)。
AZD1222以無複製能力的黑猩猩腺病毒作為載體,插入新型冠狀病毒基因(其中包括棘突蛋白及其他抗原蛋白)。即使淨化過程非常徹底,仍會有微量細胞培養原材料(如細胞殘餘),用來溶解病毒的化學物(如Triton 100)及穩定劑。疫苗注射入體內後,載體病毒會感染人類細胞,但該病毒感染後不能複製,也不致病。被感染細胞會製造棘突蛋白,體內的樹突細胞遇到抗原(棘突蛋白)後會出現Th1免疫反應,繼而製造針對棘突蛋白的中和抗體、CD4細胞介導免疫反應(cell mediated immunity)、CD8細胞毒性T淋巴細胞免疫反應(cytotoxic CD8 lymphocyte response)。同時也會製造針對腺病毒其他成分的抗體及淋巴細胞免疫反應。
Tozinameran BNT162b2含經基因改造過的棘突蛋白核酸段(mRNA),該mRNA由脂質納米粒包裹(直徑為0.1微米),以助mRNA進入接種者細胞內。細胞其後會利用mRNA製造棘突蛋白,刺激接種者體內之Th1免疫反應,製造針對棘突蛋白之中和抗體、CD4細胞介導免疫反應、CD8細胞毒性T淋巴細胞免疫反應。經過淨化過程,疫苗中仍會含微量剩餘酵素蛋白、雙鏈RNA以及核苷三磷酸(unused nucleoside triphosphates),但此疫苗應不含動物產品。最近有報道指疫苗內用來包裹RNA之聚乙二醇(polyethylene glycol, PEG)或可引致過敏反應。
(3款疫苗第三期臨牀研究保護效力之比較,見表3,註6、7)
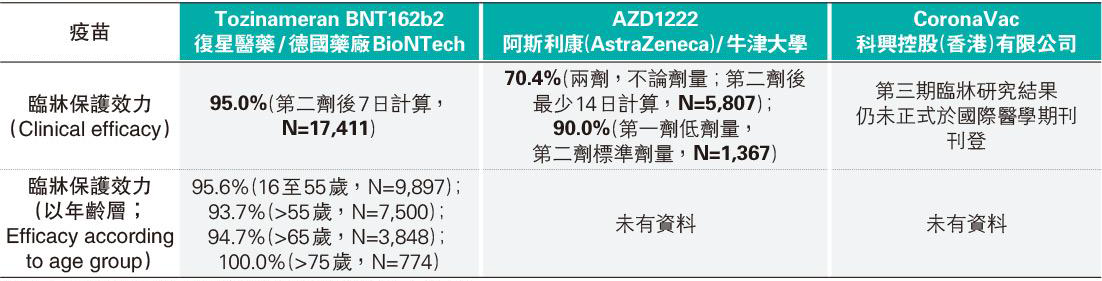
現時並無研究同時比較3隻疫苗,而各疫苗之第三期臨牀研究方法有異,故難以直接比較各疫苗誘發免疫力的效果,但3隻疫苗的臨牀保護效力均高於世衛最低要求的50%。AZD1222的最佳劑量仍未清楚,需要重做臨牀研究來確定。初步數據顯示,首劑注射較低劑量者,其臨牀保護效力達90%。反而首劑注射正常劑量者,其臨牀保護效力卻只有70.4%。Tozinameran BNT162b2的整體臨牀保護效力為95%,16歲至75歲的臨牀保護效力超過90%。CoronaVac第三期臨牀研究結果仍未正式於國際醫學期刊刊登,故暫時無數據可以用作比較。
論疫苗技術平台,滅活疫苗技術歷史悠久,其臨牀保護也有往績可尋,並且安全可靠。沿用多年的小兒麻痹疫苗、瘋狗症疫苗及甲型肝炎疫苗,均以此技術製造。接種疫苗後,中和抗體量會隨時間下降,但此現象亦可於其他技術平台出現。有憂慮指注射疫苗後,如果感染病毒,可能會出現抗體依賴免疫增強反應(Antibody dependent enhancement)。此現象理論上有可能於中和抗體量隨時間下降的時候出現,但其實這種可能性既可能發生在自然感染,也可能是在遇到疫苗耐藥性病毒時發生的。
腺病毒載體技術曾經用於研發伊波拉疫苗以控制非洲疫情,但從未被廣泛使用過。mRNA技術平台乃全新技術,暫時無後市場(post-marketing)經驗或數據可參考。
(3款疫苗第三期臨牀研究安全數據之比較,見表4)

3隻疫苗的副作用均屬輕微。約3.3%注射CoronaVac疫苗後發燒,較AZD1222(18%)及Tozinameran BNT162b2(14.2%)為低。CoronaVac的其他副作用亦較另外兩隻疫苗少。
於7174名AZD1222接種者中,有兩宗橫貫性脊髓炎個案。其中有一名病人後來證實本身乃多發性硬化症(undiagnosed multiple sclerosis)患者。至截稿時,AZD1222仍未取得藥監管當局緊急使用許可。最近英美分別報告了數宗注射Tozinameran BNT162b2後出現過敏反應,其臨牀徵狀為皮疹及喘鳴,估計有可能因為聚乙二醇而引起。
暫時無資料支持可交替使用疫苗,並會使監察副作用出現混亂情况,故現時不建議。剛感染者須待康復後4至6星期後再決定打一劑,而理論上該注射屬加強劑,但要蒐集更多數據來分析。現時亦無證據顯示剛打完疫苗之後,在短期(幾天到4周)內被感染,會影響病情,因有中和抗體,故很大機會可以使病徵更輕微。
品質監控 信心之本
有關當局為確保疫苗品質,需要GMP認可。接受疫苗的國家/地區亦可抽查每個批次數劑。可考慮以次世代基因排序法(Next generation sequencing)檢驗CoronaVac及AZD1222,確保免受外來病毒(adventitious viruses)、具複製能力的病毒及支原體污染。能以電子顯微鏡來確保棘突蛋白的數目、滅活病毒的完整性或腺病毒之外殼形狀。檢測殘餘化學物、RNA分解物或病毒蛋白,可以用高效液相色譜法(High performance chromatography)、質譜儀(mass spectrometry)或膠體電泳分析(protein gel electrophoresis)等方法。以細菌內毒素檢測(endotoxin assay)及細菌培養去確保疫苗的無菌狀態。
快打盡打 刻不容緩
經緊急立法後,由衛生署監督及批准緊急使用獲國際藥物規管機構認可及符合安全標準的疫苗。同時可於疫苗注射中心、醫院及診所預備好合規格的冷藏設施、急救工具,及預早統籌調派合資格醫護人手,為市民接種疫苗。健康部門可用電子紀錄,記錄疫苗接種日期及持續監測不良反應,定期公布每個批次抽樣的化學及微生物檢測結果,去增加公眾信心。盡早開始公眾教育計劃,確保所有疫苗資訊公開透明,而接種疫苗必須是出於自願及免費。
接種完疫苗後出現疾病或死亡個案,未必與疫苗有直接關係。以面癱(貝爾氏麻痹症,Bell’s palsy)為例,在美國3.8萬接種者出現4宗(約每10萬人有11宗),但在美國每年約10萬人便有15至20宗病例,其因果關係未曾確立。倘遇任何事故,須深入調查及盡快公布,以釋除公眾疑慮。
就現有第二及第三期臨牀研究數據而言,CoronaVac的第一二期臨牀研究數據,在眾多疫苗中似乎最安全,副作用最少,長者及長期病患者均能接受注射。但其誘發中和抗體及細胞介導免疫反應之能力較弱,故預計保護時間較短,但可以加強劑去補救中和抗體隨時間下降的問題。CoronaVac第三期臨牀研究結果仍待正式發表,須有同行評審之國際醫學期刊刊登數據後,再分析臨牀保護效力及安全數據,方可正式決定使用。
Tozinameran BNT162b2的臨牀保護效果較佳,亦相對安全。其化學成分簡單,實驗室做品質保證分析較易。
現時預先採購的3款疫苗中,Tozinameran BNT162b2及CoronaVac(仍待第三期臨牀研究結果正式發表)應為兩款先行採用之疫苗。
對醫護人員、長者、長期病患者、邊境管制人員及高危職業,應該給予機會優先注射疫苗。
AZD1222第三期臨牀研究劑問題,需靜候其重做研究的結果,並且要小心監督其副作用。尚有兩宗橫貫性脊髓炎之疑慮,要較長時間看清其副作用。過敏病史也有機會影響疫苗的選擇。食物、藥物及化妝品均有PEG,但PEG過敏非常罕見。懷疑PEG過敏者,可以研究以皮膚致敏原測試,去助有過敏史者選擇疫苗(見皮膚測試照片;註8)。

病毒不停變種,是否需要如流感疫苗般每年改變疫苗株仍屬未知之數。疫苗接種必須盡快開始,而防疫措施須維持並行一段時間,包括盡檢輕微病徵者、迅速嚴謹追蹤及檢疫隔離、全民戴口罩及遵從社區隔離措施等,去防止社區擴散,並嚴守邊境以防輸入,不能鬆懈。到疫情進一步緩解,疫苗覆蓋率足夠,才可逐步放鬆。
註3:Vaccines and Related Biological Products Advisory Committee Meeting. December 10, 2020. FDA Briefing Document. Pfizer-BioNTech COVID-19 Vaccine. bit.ly/3mN7Lb4 (Accessed on 21 Dec 2020)
註6:Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine (published online ahead of print, 2020 Dec 10). N Engl J Med. 2020; 10.1056/NEJMoa2034577. doi:10.1056/NEJMoa2034577
註7:Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK (published online ahead of print, 2020 Dec 8). Lancet. 2020; S0140-6736(20)32661-1. doi:10.1016/S0140-6736(20)32661-1